年龄相关性黄斑变性(Age-related macular degeneration, AMD)占50岁以上人群不可逆盲的第二位。AMD主要分两种类型,干性(Dry AMD)和湿性(即新生血管性AMD, wet AMD, wAMD,neovascular AMD)。虽然wAMD仅占10%,但严重危及视力,自然病程发病第3年,2/3的病人视力小于0.12。AMD的确切病理机制尚不清楚,与遗传、环境因素如长期暴露在紫外线环境中、环境污染、吸烟、脂类代谢异常及抗氧化水平下降等因素有关。抗新生血管生长因子(Vascular endothelial growth factor, VEGF)治疗是wAMD里程碑性的进展,大大降低了世界范围内不可逆盲的发病率。尽管如此,这种治疗仍是不完美的,复发、难治性和瘢痕化等,使得视力改善仍不尽如人意。 据Seven-up study7公布的7年以上雷珠单抗治疗的随诊结果,与治疗基线相比,在治疗头2年里,平均视力稳步提高,最高达11.2个字母,但之后逐渐下降,7年以上平均视力下降8.6个字母,并有继续下降和出现地图样视网膜变性(Geographic atrophy, GA)或原有GA加重的趋势;其中,1/3病人视力稳定,1/3病人视力提高,而1/3病人下降15个字母以上(3行以上)。由于目前临床上对于发生在黄斑中心wAMD的治疗方法主要是抗VEGF玻璃体腔注射、光动力疗法,它们都是针对血管的治疗,价格昂贵,需反复多次治疗,给病人带来了严重的经济负担,无效及难治性病例也不少见。因此,wAMD的治疗仍面临着巨大挑战。本系列文章从血管的角度,综合文献报道,分析抗VEGF治疗效果差异的原因,提出根据血管成熟度选择治疗手段,并综述难治性wAMD的治疗进展,介绍国外已进入临床试验的一些重要药物。
一、新生血管形成过程与细胞因子
脉络膜新生血管化(Choroidal vascularization,CNV)是wAMD主要病理基础。血管新生(Angiogenesis)是一个极其复杂的生长过程,有很多种细胞因子参与。简单的说,在致病因素的作用下,在VEGF等细胞因子的作用下,内皮细胞迁移增殖,形成管状结构,继而在血小板源性生长因子(Platelet-derived growth factor, PDGF)及其受体信号通路的各种因子作用下,周细胞迁移包绕管状结构,加上细胞外基质及肌纤维母细胞,进而形成稳定的成熟血管。新生血管从发芽(Sprouting)开始,经历从幼稚期到逐渐成熟稳定,从内皮细胞围绕的细小管径、容易破裂出血、渗漏,逐渐管径增粗、管壁增厚,到有周细胞、细胞外基质及平滑肌包绕而形成的小动脉分支,并逐渐稳定,不易发生渗漏及出血。CNV经历上述过程,形成粗大的小动脉分支,即小动脉化的CNV(Arteriolized CNV)。
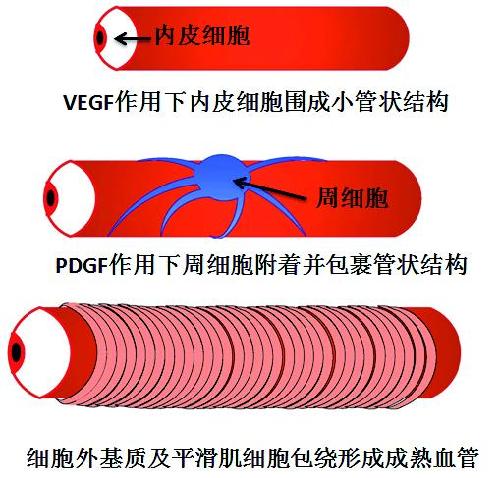
新生血管形成过程
二、吲哚青绿造影(Indocyanine green angiography, ICGA)指导观察新生血管形态
临床医生通过对血管形态的判断,可以大致估计新生血管处于幼稚期还是成熟期,经比较能清晰显示血管形态的检查方法是ICGA。 典型的CNV在ICGA下显示由三部分组成,滋养动脉(Feeder artery)、视网膜下纤维血管团(Subretinal fibrovascular complex)、回流静脉(Draining vein)。但根据CNV形成阶段不同,可以表现为各种形态。Scotts Cousins用动态ICGA观察,按形态及组成成分不同将CNV分为3种类型,毛细血管型CNV(主要由毛细血管组成,很少的小动脉和短小管径的滋养动脉)、混合型CNV(毛细血管、小动脉、滋养动脉)、小动脉型CNV(分支动脉型,主要由小动脉组成,少量的毛细血管和长的大管径的滋养动脉)。上述3种类型,也分别代表了CNV的血管成熟程度,毛细血管成分越多,成熟度越低;血管越粗大,小动脉比例越多,成熟度越高。CNV在晚期有大量的纤维瘢痕混杂,此时往往不易辨别血管的形态。
息肉样脉络膜血管病(Polypoidal choroidal vasculopathy,PCV) 是湿性AMD的一种特殊类型,以异常的分支血管网和末端膨大的息肉样病变为特征。虽然部分PCV可以合并CNV, 但PCV的病理基础是发生在脉络膜的粗大的小动脉的内弹力层病变和血管壁的动脉粥样硬化改变,因此从结构来讲,是发育成熟后的血管异常。这也是VEGF治疗效果不佳的原因之一。
三、根据血管形态选择治疗方式
Scotts Cousins还发现,毛细血管型的CNV对抗VEGF治疗敏感,而对小动脉型的CNV不敏感。小动脉化的CNV往往需要频繁的注射或联合PDT治疗。罗灵等用ICGA观察wAMD伴有渗出性PED的病人中,ICGA显示成熟化的血管(PCV或含有小动脉分支)占多数(78%)。对于混合毛细血管及较成熟血管的CNV病例,经抗VEGF治疗后,毛细血管团消失而粗大的动脉对治疗无反应。
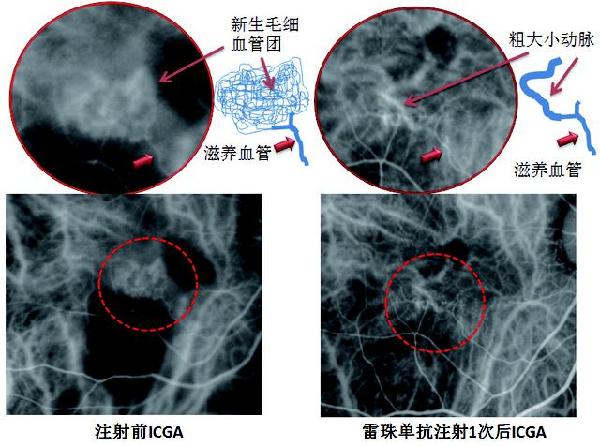
ICGA显示治疗前后血管的变化
毛细血管团经雷珠单抗治疗1次后消失,残留滋养血管及粗大异常的脉络膜小动脉。
因此,ICGA显示的异常血管为粗大的滋养血管或者小动脉分支,往往预示着抗VEGF治疗对其效果不佳或需要反复注射但也仅仅能减少渗出,异常的粗大血管很难消除,此时需要结合PDT治疗。
参考文献:
1.GLOBAL DATA ON VISUAL IMPAIRMENTS 2010 (World Health Organization);http://www.who.int/blindness/GLOBALDATAFINALforweb.pdf.
2.Ambati J, Ambati BK, Yoo SH, Ianchulev S, Adamis AP. Age-related macular degeneration: etiology, pathogenesis and therapeutic strategies. Survey of ophthalmology 2003;48:257-293.
3.Cousins S. Clinical Value of ICG Angiography in Eyes that Fail anti-VEGF Therapy. 2013.
4.Joussen AM, Bornfeld N. The treatment of wet age-related macular degeneration. Dtsch Arztebl Int 2009;106:312-317.
5.Grunwald JE, Daniel E, Huang J, et al. Risk of geographic atrophy in the comparison of age-related macular degeneration treatments trials. Ophthalmology 2014;121:150-161.
6.Daniel E, Toth CA, Grunwald JE, et al. Risk of scar in the comparison of age-related macular degeneration treatments trials. Ophthalmology 2014;121:656-666.
7.Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, Group S-US. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN-UP). Ophthalmology 2013;120:2292-2299.
8.Ferrara N. The role of VEGF in the regulation of physiological and pathological angiogenesis. Exs 2005;209-231.
9.Leveen P, Pekny M, Gebre-Medhin S, Swolin B, Larsson E, Betsholtz C. Mice deficient for PDGF B show renal, cardiovascular, and hematological abnormalities. Genes & development 1994;8:1875-1887.
10.Carmeliet P, Mackman N, Moons L, et al. Role of tissue factor in embryonic blood vessel development. Nature 1996;383:73-75.
11.Clauss M, Breier G. Mechanisam of angiogenesis: Birkhäuser Verlag, Basel - Boston - Berlin; 2005: 116-120; 261-299:116-120.
12.Mousa SA, Lorelli W, Campochiaro PA. Role of hypoxia and extracellular matrix-integrin binding in the modulation of angiogenic growth factors secretion by retinal pigmented epithelial cells. Journal of cellular biochemistry 1999;74:135-143.
13.Carmeliet P, Collen D. Molecular basis of angiogenesis. Role of VEGF and VE-cadherin. Annals of the New York Academy of Sciences 2000;902:249-262; discussion 262-244.
14.Cousins S. Serous PEDs: Role of ICG Angiography in Diagnosis and Management. Hawaii Eye Conference. Hawaii; January 19-25, 2013.
15.Yuzawa M. [Polypoidal choroidal vasculopathy]. Nippon Ganka Gakkai zasshi 2012;116:200-231; discussion 232.
16.Tamura H, Tsujikawa A, Otani A, et al. Polypoidal choroidal vasculopathy appearing as classic choroidal neovascularisation on fluorescein angiography. The British journal of ophthalmology 2007;91:1152-1159.
17.Kuroiwa S, Tateiwa H, Hisatomi T, Ishibashi T, Yoshimura N. Pathological features of surgically excised polypoidal choroidal vasculopathy membranes. Clinical & experimental ophthalmology 2004;32:297-302.
18.Cheung CM, Li X, Mathur R, et al. A prospective study of treatment patterns and 1-year outcome of asian age-related macular degeneration and polypoidal choroidal vasculopathy. PloS one 2014;9:e101057.
19.罗灵, 仇长宇, 伍春荣等. ICG指导下渗出性PED的分型及治疗策略. 中华医学会第十八届全国眼科学术会议. 中国厦门; 2013.9.13-17.